针对表观遗传酶的肿瘤靶向治疗
表观遗传(epigenetics)指的是对DNA双螺旋表面以及组蛋白的化学修饰。这些变化控制着DNA的紧密包装程度,以及细胞对其信息的可获取程度。
有个知识点很有用:我们身体每个细胞内的DNA大约有两米长。这些 DNA必须经过包装才能被细胞妥善处理。包装的第一层是DNA链缠绕在组蛋白上。一段缠绕在一组 8个组蛋白上的DNA被称为核小体。核小体随后会进一步盘绕、堆叠并连接成环,形成染色体。
1 基因的表观遗传调控
基因包含着告诉细胞如何合成蛋白质的关键信息。如果一个基因的 DNA 包装得很紧密,细胞就无法获取其信息,也就不能合成相应的蛋白质。但如果基因包装松散,核小体间距适宜,基因的信息就更容易被获取。
名为表观遗传调控因子的蛋白质通过对DNA和各种组蛋白进行微小的化学(表观遗传)修饰,来控制DNA的包装。
当DNA及其缠绕的组蛋白上连接有甲基时,核小体会紧密堆积(图 1a)。如果这些甲基被移除,取而代之的是乙酰基,结构就会松弛(图1b)。这些变化控制着该区域的基因是活跃还是不活跃(即它们是否能被用来合成蛋白质)。
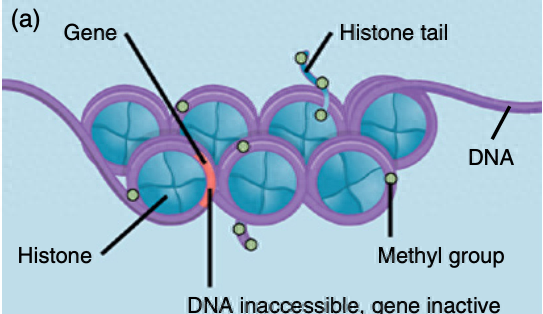
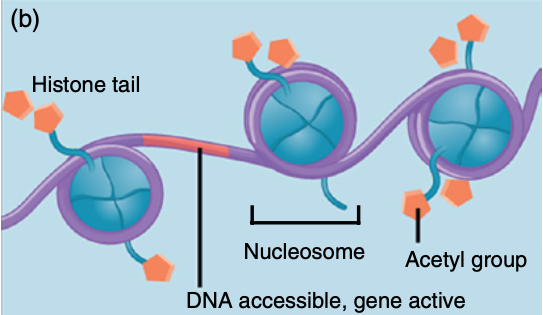
图1 对DNA和组蛋白的表观遗传修饰改变了基因的活性。(a)在DNA和组蛋白中添加甲基会导致核糖体紧密地聚集在一起。这使得DNA无法接触到转录因子,该地区的基因不能用于制造蛋白质。(b)组蛋白的乙酰基(乙酰化)的添加会松动核糖体的包装,并允许它们沿着DNA扩散。该地区的DNA现在可以接触到转录因子,转录因子触发基因转录和翻译,导致蛋白质的产生。
2 表观遗传学与癌症
这听起来可能相对简单,但事实并非如此!有超过700种表观遗传调控因子控制着何时、何地、为何以及哪些小化学基团(甲基、乙酰基及许多其他基团)会附着到DNA和组蛋白上,以及何时会被移除。在癌细胞中,几乎所有这些蛋白质都发现了突变。
当然,表观遗传酶活性的任何变化所产生的影响,都取决于由此导致哪些基因变得活跃或不活跃。表观遗传酶影响细胞行为的方方面面,因为它们影响着每一个基因。癌细胞中的基因突变和表观遗传改变之间也存在相互作用(见图2a 和 b)。
让科学家们感到兴奋的表观遗传学方面之一是,表观遗传变化是可逆的(如图2a、f 和 g 中的蓝绿色箭头所示)。甲基可以被添加也可以被移除,乙酰基以及 DNA 和组蛋白的其他表观遗传修饰也是如此。这与基因突变形成鲜明对比 —— 一旦 C 变成了 G,或者染色体断裂后修复不当,就无法恢复了(图2c 和 d)。
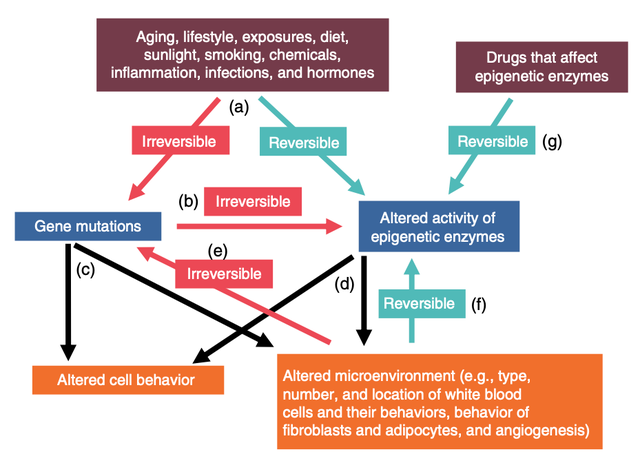
图2 癌症基因突变与表观遗传学改变之间的关系。(a)许多因素,如衰老过程、暴露和生活方式,都可能导致基因突变和表观遗传学变化。在基因突变的情况下,这些变化是不可逆转的。然而,表观遗传学变化是暂时的,并且可能是可逆的。(b)有时基因突变会影响表观遗传酶的基因,永久改变相应蛋白质的活性。(c)基因突变会影响细胞的行为并影响其微环境,(d)表观遗传酶的改变活性也是如此。(e)微环境中释放的分子,如白细胞产生的氧自由基,可以提高细胞的突变率。(f)细胞的行为,如成纤维细胞,以及各种蛋白质、营养素和氧气水平的存在,都会(可逆地)改变细胞中表观遗传酶的活性。(g)科学家开发了阻断一些表观遗传酶活性的药物,如DNA甲基转移酶(DNMT)和组蛋白去乙酰化酶(HDAC)抑制剂。
表观遗传变化的这种可逆性为科学家们研发改变表观遗传酶活性的药物铺平了道路。他们的推理是,例如,如果一个过度活跃的甲基转移酶阻止了肿瘤抑制基因的转录,那么一种合适的抑制剂就可以逆转这种情况(图 2e)。
3 针对表观遗传酶的治疗方法
尽管表观遗传学很复杂,且在癌细胞中存在多种缺陷形式,但我们确实有一些已获批的治疗方法,它们通过阻断某些相关酶发挥作用(详情见表 1)。但是,与针对核转运的治疗方法一样,我们几乎不可能确切知道这些治疗方法有效的具体原因。

表1癌细胞中常见的表观遗传酶改变以及一些针对它们的药物。
3.1 DNA 甲基转移酶抑制剂
DNA 甲基转移酶(DNMT)抑制剂包括阿扎胞苷和地西他滨。这些药物模拟胞嘧啶(一种DNA碱基),并进入细胞的DNA和RNA中。一旦进入,药物就会与DNMT酶发生化学结合,将其固定住,阻止它们对DNA和RNA进行甲基化(即添加甲基)。因此,这些药物被称为 “低甲基化剂”(因为它们阻止甲基化,细胞的DNA和RNA会出现甲基化不足)。然而,蛋白质(这里指 DNMT)与DNA的结合对细胞来说也具有极大的毒性,会导致 DNA 双链断裂,进而触发细胞死亡。
DNMT抑制剂已被批准用于治疗急性髓系白血病(AML)。有大量证据表明,有缺陷的表观遗传酶在 AML 中很重要,而且这些缺陷在疾病发展早期就会出现。例如,AML 细胞中各种表观遗传酶的基因突变很常见(如影响 IDH1、IDH2、DNMT3A、ASXL1 和 TET2 的突变)。
像阿扎胞苷和地西他滨这样的DNMT 抑制剂对 AML 有治疗作用,可能是因为这种疾病中存在表观遗传酶的缺陷。但和其他影响表观遗传酶的治疗方法一样,我们很难确切知道具体机制。
3.2 EZH2 抑制剂
EZH2蛋白是一种名为PRC2的大型蛋白质中的酶部分,而PRC2是一种组蛋白甲基转移酶。PRC2将甲基添加到组蛋白上,导致多种基因被抑制。非霍奇金淋巴瘤(NHL)如滤泡性淋巴瘤和弥漫性大B细胞淋巴瘤的细胞有时会含有EZH2基因突变。这些突变会增强 PRC2 的活性,加剧对基因的抑制。他泽司他是一种EZH2抑制剂,已被批准用于治疗含有 EZH2突变的滤泡性淋巴瘤患者。
3.3 IDH1 和 IDH2 抑制剂
有一组表观遗传修饰因子的作用机制(相对)更容易理解,那就是异柠檬酸脱氢酶 1(IDH1)和 IDH2 抑制剂,包括艾伏尼布和奥芦替尼(阻断 IDH1)、恩西地平(阻断 IDH2)以及伏拉塞尼布(阻断 IDH1 和 IDH2,且具有更好的脑穿透性)。
这些治疗方法似乎对含有 IDH1 或 IDH2 基因突变的癌症最有效。由这些基因产生的 IDH1 和 IDH2 蛋白是间接减少 DNA 和组蛋白甲基化的酶。当它们发生突变时,其作用会发生改变,导致甲基化增加。除此之外,它们的作用机制再次变得模糊,因为甲基化的后果是多样的,且取决于具体情境。此外,IDH1 和 IDH2 酶除了影响甲基化外,还会影响细胞代谢,这使得 IDH 抑制剂的影响更难弄清楚。
含有 IDH1 或 IDH2 突变的癌症包括:
80% 的低级别胶质瘤(生长缓慢的脑肿瘤)
15%-20% 的急性髓系白血病和骨髓增生异常综合征
15%-20% 的肝内胆管癌(发生在肝脏内的胆管中)
50%-90% 的软骨肉瘤(由软骨中有缺陷的细胞发展而来的骨癌)
到目前为止,IDH 抑制剂已被批准用于治疗患有 IDH1 或 IDH2 突变的急性髓系白血病、骨髓增生异常综合征或胆管癌患者。在软骨肉瘤患者中靶向 IDH 酶是否有效仍不明确。伏拉塞尼布是一种能够穿透脑组织的 IDH1 和 IDH2 抑制剂,作为 IDH 突变的低级别胶质瘤的治疗方法,前景看好。
3.4 HDAC 抑制剂
组蛋白去乙酰化酶(HDAC)抑制剂(如帕比司他、贝利司他、伏立诺他和罗米地辛)可阻止组蛋白上的乙酰基被移除。其原理是,当组蛋白的乙酰基完整时,DNA 处于松弛状态,肿瘤抑制蛋白的基因会活跃起来。人们认为这些蛋白质随后会发挥有益作用,比如阻止细胞进一步生长,促使细胞分化而非增殖。但实际上,没人确切知道 HDAC 抑制剂是否是通过这种方式发挥作用的。
我们的细胞中有 11种不同的 HDAC 酶,它们不仅会从细胞核内的组蛋白上移除乙酰基,还会从细胞质中的许多蛋白质上移除乙酰基。因此,没人能确定 HDAC 抑制剂对肿瘤抑制基因的影响是否是其发挥作用的原因。也有可能是它们对细胞质蛋白质的影响在起作用。
尽管我前面概述了诸多复杂性,但表观遗传酶仍然是新的癌症治疗的有希望的靶点。但重要的是要记住这个系统有多复杂:数量庞大的表观遗传调控因子、对它们产生影响的多种不同因素,以及它们影响细胞行为的多种方式。这使得每项试验的结果都难以解释或改进。


